自从2018年诺贝尔生理学或医学奖授予美国科学家James Allison和日本科学家本庶佑,以表彰他们发现了抑制免疫负调节的癌症疗法——“免疫检查点疗法”后,免疫治疗成为了当前恶性肿瘤治疗最热门的话题,而针对PD-1/PD-L1的免疫检查点抑制剂是这些免疫治疗的重中之重。
免疫检查点是指免疫系统中存在的一些抑制性信号通路,例如PD-1/PD-L1通路和CTLA-4通路。PD-1,即程序性死亡受体1,是T细胞表面的一个引子。正常情况下,T细胞可以识别和杀灭细菌、病毒以及身体内变异细胞等功能,而T细胞在未活化时几乎不表达PD-1,仅在T细胞活化之后才会诱导表达PD-1。PD-1除了表达于活化的T细胞,还在活化的B细胞、NK细胞、单核细胞以及部分肿瘤细胞中表达。PD-L1是PD-1的配体,当这个配体和T细胞的PD-1蛋白配对结合,就好对免疫系统行使“刹车”的作用,使免疫细胞失去攻击能力,以提醒T细胞不要“误杀自己人”。而肿瘤细胞利用人体免疫系统的特性,通过细胞表面过度表达PD-L1,伪装成正常细胞,从而抑制T细胞的活化和增殖,导致T细胞无法发挥杀死癌细胞的作用。
肿瘤细胞是如何导致其PD-L1表达增高呢。一些研究发现肿瘤细胞不仅可以通过EGFR、MAPK或PI3K-Akt通路的激活,STAT3蛋白高表达和HIF-1转录因子等上调PD-L1的表达,还可以通过编码PD-L1的基因扩增、EB病毒诱导、表观遗传学、以及肿瘤微环境中的炎症因子(特别是γ-干扰素)的刺激等因素调节其高表达。
PD-1/PD-L1抑制剂是免疫检查点的单抗药物,是近年来肿瘤免疫疗法研究的热点。它可以通过阻断PD-1和PD-L1的结合,使肿瘤细胞对T细胞“松绑”,恢复T细胞的抗肿瘤活性。T细胞激活后可以攻击肿瘤细胞,抑制肿瘤细胞的生长甚至导致肿瘤细胞死亡而达到治疗的目的。2014年以来,FDA已批准纳武单抗(nivolumab)、派姆单抗(perbrolizumab),阿替珠单抗(atezolizumab,)、度伐单抗(durvalumab)、阿维单抗(avelumab)和Cemiplimab用于多种恶性肿瘤的治疗,包括非小细胞肺癌、恶性黑色素瘤、膀胱癌和霍奇金淋巴瘤等。纳武利尤单抗是中国大陆首个获药监局批准的免疫检查点抑制剂,批准用于治疗EGFR基因突变阴性和ALK阴性、既往接受过含铂化疗方案后疾病进展或不可手术的局部晚期或转移性非小细胞肺癌成人患者。派姆单抗国内获批适应症是不可切除或转移性黑色素瘤。
这类免疫检查点抑制剂的疗效已在临床实验中显示出阳性结果,疗效明确,且副作用比常规化疗少,但如何进一步提高患者获益,仍是临床关注的重点。因此,预测性生物标志物的鉴定成为研究和药物开发的重点。而在肿瘤组织中进行PD-L1免疫组化表达,是第一个经临床验证的预测生物标志物,已应用于临床实践并且在不同瘤种中得出不同结论。例如 CheckMate-017研究结果显示,非小细胞肺鳞癌患者的获益与PD-L1表达无关。 而在CheckMate-057、KEYNOTE-010等多个临床试验数据均表明患者对PD-1抑制剂的客观缓解率与PD-L1表达水平相关,而且部分PD-L1表达阴性的患者也有生存获益。大量研究表明,肿瘤组织样本中PD-L1表达水平越高,则意味着患者可能从PD-1/PD-L1抑制剂治疗中获益更大。肿瘤组织PD-L1表达水平评估是目前临床研究、验证和认可度最广泛的PD-1/PD-L1抑制剂疗效预测标志物。
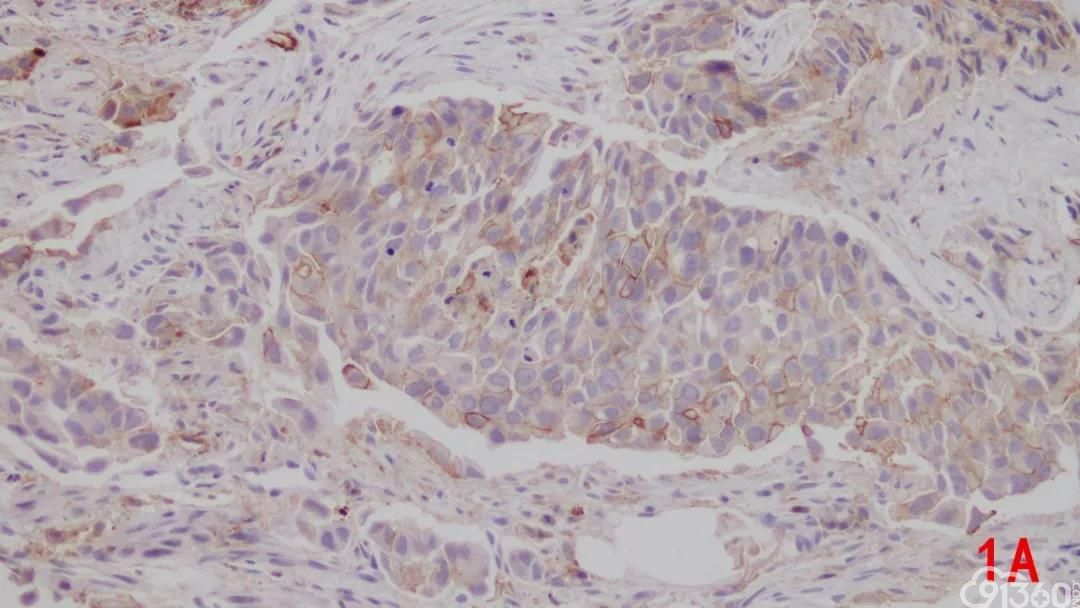
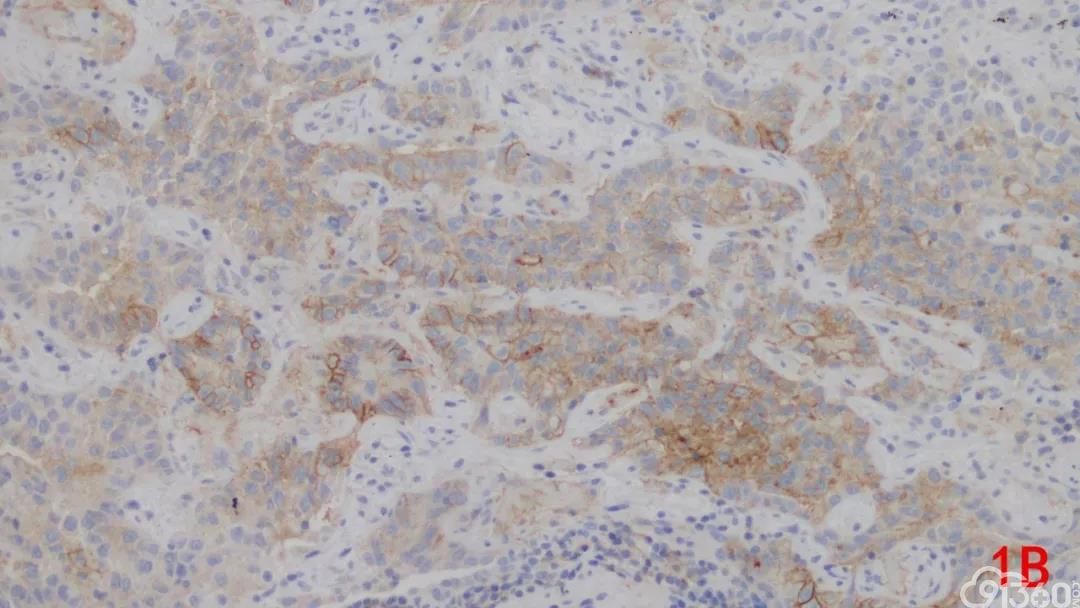
图1A PD-L1在NSCLC中的表达,PD-L1表达于肿瘤细胞的细胞膜;图1B PD-L1在肺腺癌中的表达,PD-L1呈不同阳性强度表达。
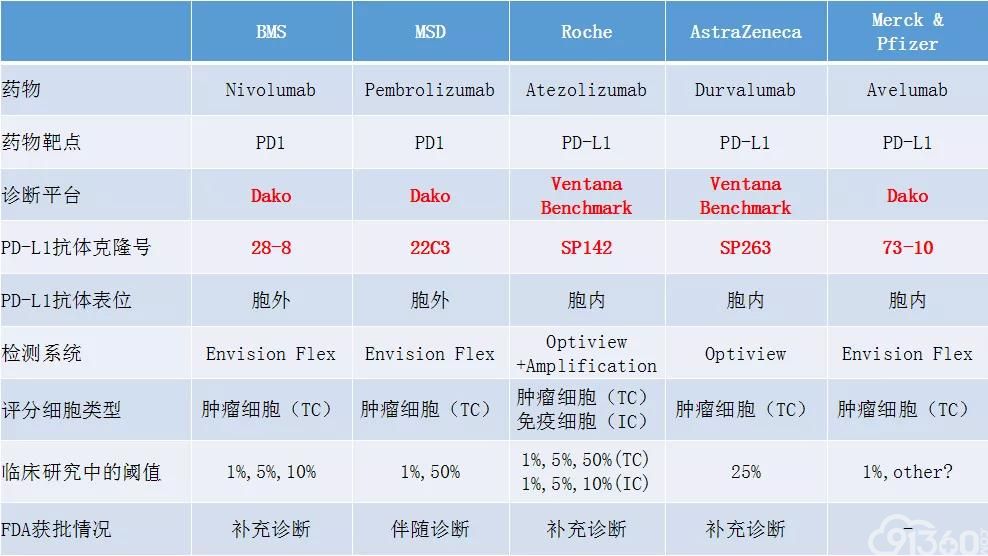
免疫组化方法学是临床评估肿瘤组织PD-L1表达水平的唯一方法学。目前多个PD-1/PD-L1通路抑制剂都有其各自不同的免疫组化检测试剂和检测平台,主要为两家公司的4种抗体检测平台,分别为Dako28-8和22C3检测在DakoAutoStainer Link 48平台优化,而Ventana SP142和SP263针对VentanaBencchMarker平台进行优化。从国际上已报道的研究来看,针对以上4种PD-L1表达检测,研究显示Dako 28-8,22C3和SP263具有较好的一致性,在PD-L1肿瘤细胞膜染色不同阈值(1%、10%、25%和50%)的比较上,三种方法的总体一致率>90%。而由国际肺癌研究协会(IASLC)发起的Blueprint研究结果显示28-8,22C3和SP263在肿瘤细胞染色上有较高的一致性,SP142染色阳性肿瘤细胞比其他3种抗体少。PD-L1结果判读上,研究发现经过培训的病理医生在肿瘤细胞PD-L1表达(TPS)判读上具有较高的一致性,但对免疫细胞的PD-L1表达(TILs)判读的一致率较低。不同的免疫检查点抑制剂具有不同的PD-L1检测试剂盒、检测平台和评分方法,具体见表1。
目前常用于NSCLC的5种PD-L1 免疫组化检测试剂
PD-L1作为生物标志物具有不同诊断级别,对于肺鳞癌患者PD-L1无论表达与否,都能从纳武单抗二线治疗中获益,因而,对于肺鳞癌患者无需检测PD-L1。而对于非鳞、非小细胞肺癌患者,PD-L1则作为补充诊断,为纳武单抗和atezolizumab的提供治疗有效性的相关信息。另外,PD-L1可作为派姆单抗的伴随诊断,当肿瘤细胞PD-L1≥50%可作为一线治疗,肿瘤细胞PD-L1≥1%作为二线治疗时使用。临床实验结果显示在肺癌以外的其他有些器官肿瘤中,复合性阳性计数(CPS)的概念及不同的界值也会提示肿瘤免疫治疗疗效。
目前PD-L1检测仍然存在一些问题,包括:检测技术方面,如不同的检测抗体、平台以及不同的阈值的问题;生物学方面,如肿瘤内和肿瘤间异质性;组织来源方面,如细胞学标本,存档标本与新鲜标本,原发部位与转移灶等。目前PD-1/PD-L1抑制剂都有对应的PD-L1检测方法,但是每种检测所用到的抗体和技术都不同,导致PD-L1表达水平的设定不同,同时对于不同的瘤种PD-L1表达水平的设定也不同。有研究发现PD-L1在手术切除的NSCLC样本中的3个单独的组织块上的表达,肿瘤细胞表达的一致性较高,而免疫细胞表达的一致性较低。有研究对比NSCLC的手术标本和活检标本进行PD-L1免疫染色结果,发现无论是肿瘤细胞还是免疫细胞均有较大差异。同样 PD-L1表达具有动态变化的特点,随时间和治疗应答而波动、上调或下调,并且关于存档标本与新鲜标本的之间也是研究关注的焦点。但是在NSCLC中的相关研究表明,无论是新鲜标本还是石蜡标本,PD-L1检测都具有临床价值。然而,这方面的研究几乎为国外研究数据,缺乏国内的数据,需要加强这方面的研究。
PD-L1检测存在着上述诸多问题,解决这些问题不是一蹴而就,国内需要积极开展各平台、各抗体和各种操作流程的PD-L1检测一致性研究;在循证医学下设定统一的判读标准和阈值;另外,PD-L1检测结果的病理报告应设立统一的规范和标准模式。依据中国数据制定符合中国国情的PD-L1检测指南或共识,指导临床检测的常规开展,从而更好的指导临床治疗。
