
韩安家 主任医师,教授
博士生导师
中山大学附属第一医院病理科主任
病理学院院长
中华医学会病理学分会常委
中华医学会病理学分会软组织和骨学组副组长
中国医师协会病理科医师分会常委
广东省医学会病理学分会主委
广东省卫健委县级医院学科带头人
病理科培训基地召集人
广东省粤港澳合作促进会医药大健康委员会病理联盟主委
目前已有4种PD-1/PD-L1抑制剂相关的免疫治疗药物(纳武利尤单抗、帕博利珠单抗、atezolizumab、durvalumab)被美国FDA和欧洲药品管理局批准用于非小细胞肺癌(NSCLC)的一线或二线治疗。其中,纳武利尤单抗在我国已获批NSCLC适应症,帕博利珠单抗单药已获批黑色素瘤适应症,联合化疗获批非鳞癌的NSCLC适应症。
不同免疫治疗药物治疗不同恶性肿瘤时评估PD-L1表达的细胞不同,有的仅评估肿瘤细胞(TC),有的需要评估肿瘤细胞和肿瘤浸润性免疫细胞(IC)。PD-L1检测的国内现状如何?存在哪些问题?病理科如何做一个规范的PD-L1检测?
PD-L1表达特征及检测的临床意义
PD-1(programmed death 1)程序性死亡受体,是一种重要的免疫抑制分子,为免疫球蛋白超家族,表达于活化的T淋巴细胞、B淋巴细胞、单核细胞、NK细胞等免疫细胞表面。PD-L1是PD-1的配体,表达于多种肿瘤细胞、抗原提呈细胞(APC)、组织细胞表面。当其与T细胞表面的PD-1结合后,会抑制T细胞的活化和增殖,肿瘤细胞通过过度表达PD-L1,从而导致T细胞无法发挥杀死肿瘤细胞的作用[1]。目前的PD-1/PD-L1免疫检查点抑制剂药物主要通过阻断PD-1和PD-L1(/L2)的结合,恢复T细胞的抗肿瘤活性[2](图1)。通过PD-L1的检测,可以更好地指导临床医生对恶性肿瘤进行免疫抑制剂治疗,以达到更好的治疗效果。因此, PD-L1检测是目前临床最重要的恶性肿瘤免疫治疗Biomarker。
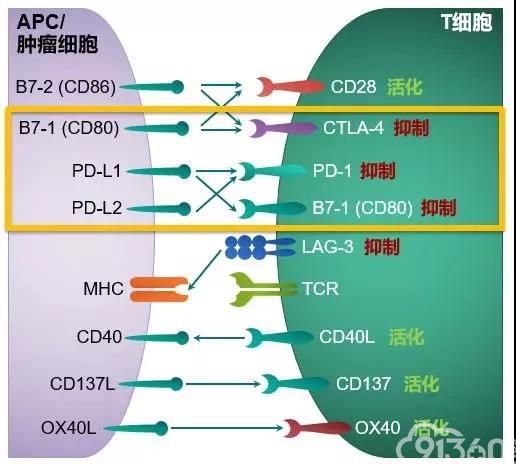
图1 T细胞的活化程度和质量取决于活化信号和抑制信号之间的平衡[3]
哪些患者需要进行PD-L1检测
理论上,免疫治疗是一种泛瘤种的治疗方式,但是由于恶性肿瘤的异质性和发生发展机制的复杂性,目前FDA仅批准那些经过了严格的临床试验并且取得良好治疗效果的恶性肿瘤才能进行免疫治疗。 PD-L1检测被进一步分为伴随诊断和补充诊断。根据美国FDA的定义,伴随诊断是一种体外诊断技术,能够提供患者针对特定药物的治疗反应的信息,这些信息“对于安全有效地使用相应的药物或生物产品是必不可少的”,而补充诊断可用于治疗选择,但不被认为是在实践中使用相应治疗所必需的[4](图2)。基于FDA获批NSCLC适应症的推荐,帕博利珠单抗采用PD-L1作为伴随诊断,纳武利尤单抗采用PD-L1作为补充诊断。因此,PD-L1检测取决于肿瘤类型、一线治疗还是二线治疗、单药免疫治疗还是联合免疫治疗等因素,不能一概而论。
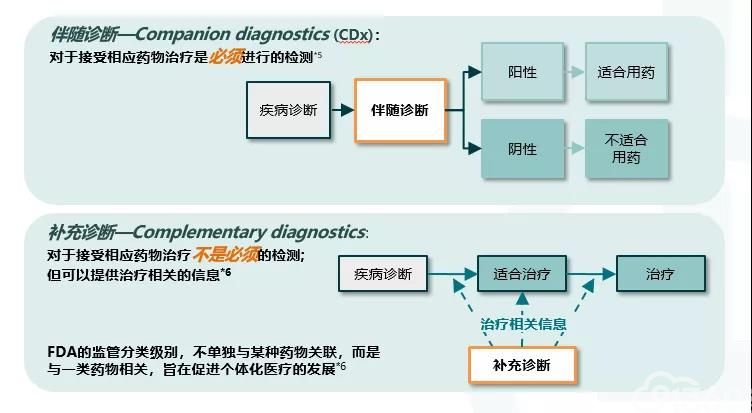
图2 PD-L1作为Biomarker的诊断级别:伴随诊断 vs. 补充诊断
PD-L1检测的国内现状及存在的问题
PD-L1检测虽然已经成为NSCLC免疫治疗的一个重要生物标志物,但国内有相当大一部分患者未能进行PD-L1检测或检测无标准化。PD-L1检测需要专门的Dako或Roche检测平台、专门克隆号的抗体及其检测试剂盒,PD-L1检测结果的判读也需要专门的培训。然而,目前国内拥有专门检测设备的医院并不多,我国还没有获批的PD-L1检测试剂盒,这些都导致了国内PD-L1检测结果良莠不齐。另外,PD-L1检测需要规范化的检测流程,如PD-L1检测还涉及到组织固定等问题,组织固定不佳会影响PD-L1的免疫组化染色结果。
PD-L1检测常用标本类型
根据临床上获得的样本情况,目前PD-L1检测主要是在组织标本上进行,穿刺和手术切除标本均可以进行PD-L1检测。由于PD-L1表达存在异质性,因此,应优先使用手术切除标本。如果患者不能进行手术切除,可以使用穿刺活检进行病理学检查,不仅可以明确诊断,而且还能进行相关基因检测。当肿瘤发生复发或转移时,PD-L1检测应采用复发或转移瘤的标本。如果不能获得组织标本,细胞学标本也可以进行PD-L1检测,但应做成细胞蜡块以富集肿瘤细胞再进行检测[5]。含有骨组织的肿瘤样本,原则上不能进行PD-L1检测,这是由于脱钙液可破坏抗原,从而影响抗原表达,采用温和的EDTA而不是硝酸进行脱钙是否会提高PD-L1检测目前还不清楚,需要进行相关的对比研究。循环肿瘤细胞(CTC)作为液体活检的一种,在靶向药物治疗中发挥重要价值。文献报道CTC中可以进行PD-L1检测[6],但CTC中PD-L1表达与组织中PD-L1表达是否存在一致性以及能否指导临床免疫检查点抑制剂的治疗还需要进一步研究。
PD-L1免疫组化前处理条件
PD-L1免疫组化结果质量,除了检测的标本来源,标本的前期处理也至关重要。所有进行PD-L1检测的标本均要使用10%中性福尔马林固定12-72小时,而且组织处理过程中的浸蜡温度应控制在60℃或以下,切片厚度应为4~5μm厚,58±2℃下烘干1小时,石蜡包埋后的组织切片应在4℃下保存,且应在6个月内进行染色。一般来说,超过5年的蜡块由于抗原可能丢失而不宜进行PD-L1检测,潮湿环境中发霉的蜡块也不能进行PD-L1检测。
PD-L1克隆号及检测平台的选择
目前已有一些商品化的PD-L1免疫组化检测试剂,包括Dako公司的28-8和22C3克隆号,以及Ventana公司的SP263和SP142克隆号[7]。然而,国内不是所有医院都拥有这些检测平台,这就导致PD-L1检测结果无标准化,最终会影响到临床免疫药物的治疗。对于实验室自己建立的PD-L1检测流程,如果没有与标准化实验室检测进行对比,其检测结果需要重新评估。
PD-L1的cut-off值选择[8]
对于PD-L1阳性表达的cut-off值问题,由于检测平台、抗体克隆号以及肿瘤标本的不同,PD-L1的阳性表达cut-off值还没有统一的标准。目前不同临床试验设定的PD-L1 cut-off值为1%、5%、25%和50%,取决于不同瘤种和不同药物[9]。有的只计算肿瘤细胞表达的比例,有些不仅要计算肿瘤细胞,还要计算免疫细胞。比如,FDA批准的帕博利珠单抗单药的一线NSCLC适应症,要求肿瘤细胞PD-L1表达≥50%[10]。而纳武利尤单抗获批的二线NSCLC适应症,则无论PD-L1表达阳性还是阴性,都可以使用纳武利尤单抗,因为临床试验数据显示PD-L1<1%的患者也会有长期生存获益,但是随着PD-L1的表达增加,患者获益的几率也会增加。因此针对纳武利尤单抗,PD-L1是作为补充诊断[11]。因此,针对不同抗体和不同检测平台,及不同临床试验药物,PD-L1 cut-off值也不同。
PD-L1表达结果如何判读
PD-L1表达判读涉及到多个方面,如肿瘤细胞、免疫细胞、肿瘤细胞数量、阳性强度以及数量等。根据临床试验,不同肿瘤PD-L1判读的细胞不同,如肺癌仅判读肿瘤细胞,而胃癌、尿路上皮癌需要判读肿瘤细胞和肿瘤周围的免疫细胞。一般来说,PD-L1判读至少需要100个肿瘤细胞,当组织样本中肿瘤细胞数量不足100时,应在报告中注明检测的肿瘤细胞数量,以供临床医生参考[12]。对于PD-L1的阳性表达,不论表达强弱,只有细胞膜阳性才可以判读为PD-L1阳性。判读时,肿瘤组织内的巨噬细胞可表达PD-L1,不应将其判读为肿瘤细胞阳性。另外,还要避免判读坏死的肿瘤组织,这些肿瘤细胞可能因为肿瘤抗原弥散而造成假阳性。另外,切片边缘和挤压处出现的阳性不能作为PD-L1阳性。对于免疫细胞,需要判读淋巴细胞、浆细胞、巨噬细胞等,而纤维母细胞、平滑肌细胞、血管内皮细胞等均不能计算在内。
PD-L1免疫组化结果判读,应首先观察HE染色切片,确定肿瘤细胞的数量及在切片中的位置,然后低倍镜下观察PD-L1免疫组化切片,确定PD-L1是否阳性以及阳性部位,然后高倍镜下仔细观察符合要求的PD-L1染色的肿瘤细胞及计算百分比(图3)。对于手术切除标本,由于PD-L1表达存在异质性,此时可将切片划分为4个象限,分别计算每个象限的PD-L1阳性表达率,然后再平均即为该例肿瘤的PD-L1阳性表达率。
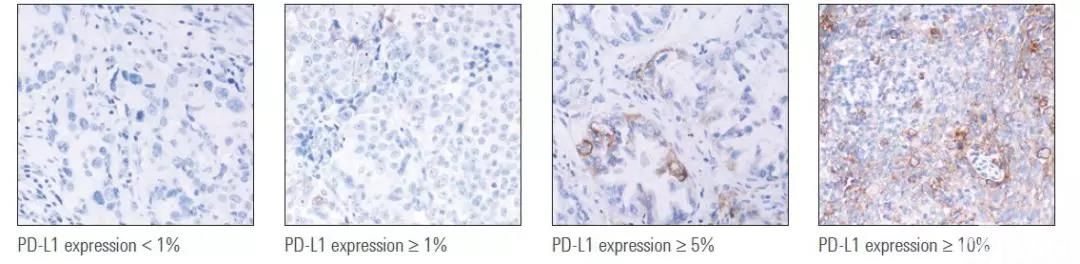
图3 PD-L1 28-8不同表达水平的NSCLC组织染色举例[13]
影响PD-L1检测结果的因素[14]
所有影响免疫组化结果的因素均可以影响PD-L1检测结果。样本固定不足或过长均会导致组织中抗原自溶或丢失,从而影响PD-L1表达结果。不同样本如组织标本、细胞学标本、血液标本均可能导致同一患者PD-L1表达结果不一致。肿瘤存在异质性,活检标本由于局限不能完全代表手术标本的实际情况以及患者的活检数量不统一也会导致PD-L1表达高估或低估。抗体不同克隆号及稀释浓度、不同检测平台也可导致PD-L1检测结果不同。结果判读中,不同观察者之间可能存在一些差异,也可导致PD-L1检测结果在不同实验室阳性率的不一致。
PD-L1的检测报告
一份完整的PD-L1检测报告不仅能够提供PD-L1的检测结果,而且还能向临床医生提供病例中可能存在的不足。PD-L1的检测报告除了提供患者的基本临床信息外,还需要提供最终的病理诊断。PD-L1检测所使用的抗体克隆号、稀释度以及检测平台、采用的抗原修复方法;PD-L1检测报告中还要提供阳性对照和阴性对照采用的组织以及阳性和阴性对照结果如何,肿瘤细胞的数量是否充足,如不足100个肿瘤细胞,则需要报告检测的肿瘤细胞数量。对于手术切除标本,还需要判断肿瘤内PD-L1表达是否存在异质性;PD-L1检测结果根据不同肿瘤类型分别给出肿瘤细胞阳性比例评分(TPS)或肿瘤细胞和免疫细胞联合阳性比例评分(CPS)。PD-L1表达可以按照1%、5%、10%、50%进行描述,也可以报告具体数值,供临床医生参考。
总之,PD-L1检测涉及到很多方面和很多因素,每个因素都可能影响到PD-L1的检测结果,从而影响临床医生对恶性肿瘤是否采用免疫治疗及其对对疗效的预测。因此,只有熟悉和了解PD-L1检测过程的每一个环节,不断加强学习、交流和培训,才能提高PD-L1检测的可靠性和结果判读的准确性。
1. Taube JM. Clin Cancer Res. 2014; 19: 5064–5074.
2. Schütz F, et al. Oncol Res Treat. 2017; 40(5): 294-297.
3. Pardoll DM. Nat Rev Cancer. 2012; 12: 252–264.
4. Hersom M, et al. Ther Drug Monit. 2018; 40(1): 9-16.
5. Elfving H, et al. Clin Lung Cancer. 2019; 20(4): 258-262.
6. Janning M, et al. Cancers (Basel). 2019 Jun 17; 11(6).
7. Hirsch FR, et al. J Thorac Oncol. 2017; 12(2): 208-222.
8. Ancevski Hunter K, et al. Mol Diagn Ther. 2018; 22(1): 1-10.
9. Naito T, et al. J Thorac Oncol. 2019 Jun 28. pii: S1556-0864(19)30501-5.
10. Pembrolizumab Labels for BLA. 2019/06
11. Nivolumab Labels for BLA. 2019/02
12. Udall M, et al. Diagn Pathol. 2018; 13(1): 12.
13. PD-L1 IHC 28-8 pharmDx. Interpretation Manual, Non-Squamous Non-Small Cell Lung Cancer.
14. Cree IA, et al. Histopathology. 2016; 69(2): 177-186.
NP/IO/4160/08/22/19-08/22/20
